|

|
|
氟,FLUORINE,源自fiuo,“流动”的意思,1771年发现。氟是所有非金属中最活泼的元素。只有少数的稀有气体元素拒绝和它相结合。它能腐蚀不为任何化学药品所动的铂。在氟气的喷流下,木材或橡胶会马上燃烧──即使是石棉也要烧得赤热。 |
氟的发现简史
莫瓦桑(H.Moissan,1852-1907)
在化学元素发现史上,持续时间最长的、参加的化学家人数相当多的、危险很大的,莫过于单质氟的制取了。氟是卤族中的第一个元素,但发现得最晚。从1771年瑞典化学家舍勒制得氢氟酸到1886年法国化学家莫瓦桑(Moissan H,1852-1907)分离出单质氟共经历了100多年时间。在此期间,不少科学家不屈不挠地辛勤地劳动,戴维、盖·吕萨克、诺克斯兄弟等很多人为制取单质氟而中毒,鲁耶特、尼克雷因中毒太深而献出了自己的生命。可以称得上是化学发展史中一段悲壮的历程。当时,年轻的莫瓦桑看到制备单质氟这个研究课题难倒了那么多的化学家,不但没有气馁,反而下决心要攻克这一难关。
莫瓦桑总结了前人的经验教训,他认为,氟这种气体太活泼了,活泼到无法分离的程度。电解出的氟只要碰到一种物质就能与其化合。强烈地腐蚀各种电极材料。如果采用低温电解的方法,可能是解决这个问题的一个途径。经过百折不挠的多次实验,1886年6月26日,莫瓦桑终于在低温下用电解氟氢化钾与无水氟化氢混合物的方法制得了游离态的氟。氟这种最活泼的非金属终于被人类征服了,许多年以来化学家们梦寐以求的理想终于实现了,莫瓦桑为人类解决了一个大难题。真是有志者事竟成!
在此之后,莫瓦桑制备出许多新的氟化物,其中最引人注目的是四氟代甲烷CF4,沸点只有258K。他的这项工作,使他成为20世纪合成一系列作为高效的制冷剂的氟碳化合物(氟利昂)的先驱。莫瓦桑一生主要从事实验工作,他一生接受过许多荣誉,他几乎是当时所有著名的科学院和化学会的成员,但他却一直保持谦虚的态度。
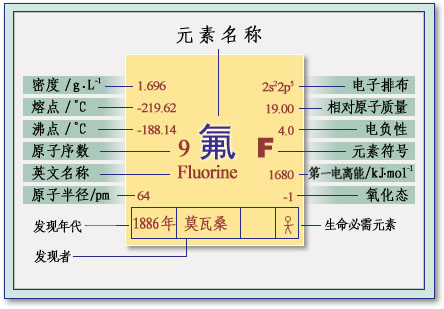
由于氟最早是从萤石中制取氟化氢而得到的,所以氟被命名为“Fluorine”,表示它来自萤石。中文按其译音定名为氟。
氟单质及其性质
氟是最活泼的非金属元素,氟单质是目前已知最强的氧化剂,所以自然界中没有游离态的氟存在,只有氟的化合物。萤石──氟化钙CaF2───就是氟的天然化合物,因为在黑暗中摩擦时发出绿色荧光而得名。
氟是人体必需的痕量元素,是形成强硬的骨骼和预防龋齿所必需的元素。人体所需的氟主要来源于饮水,人饮用水的含氟量以0.5~1.0mg/dm3比较适宜,小于此值时,龋齿病发病率高达70%~90%。饮水中含氟量超过4mg/dm3时,人易患氟骨病,骨骼畸形严重威胁人体健康。目前对氟病没有特效疗法,主要办法是降低饮水中的含氟量,煮沸是一种最简单易行的去氟方法。
氟化物无论是气态、液态还是固态都对皮肤有严重的灼伤,这是因为氟化物水解产生氢氟酸引起的。氢氟酸灼伤后不是马上感觉到的,故使伤处不易看出,经常是麻痹1~2小时后才感觉到疼痛。万一被氟化物灼伤,应立即用水冲洗,然后在伤口处敷以新配制的20%的氧化镁甘油悬浮液。
在原子能工业上,氟有着重要的用途:人们用氟从铀矿中提取铀-235,因为铀和氟的化合物六氟化铀UF6具有挥发性,用分馏法可以把它和其它杂质分开,以得到十分纯净的铀。
大量的氟用于制备氟的有机化合物,如氟利昂-12(CCl2F2)用作制冷剂,CCl3F用作杀虫剂,CBr2F2用作高效灭火剂等等。液态的氟还是火箭、导弹和发射人造卫星方面所用的高能燃料氧化剂。
由于氟的用途广泛,需求量大,因此以各种形式排入大气层的氟化物逐年增加。氟化物破坏地球的臭氧层,已经使地球的臭氧层出现了一个大洞,而臭氧层是保护地球免遭紫外线辐射的,氟造成的环境污染已经引起了人们极大的注意,氟的回收利用以及氟的代用品的研制,已经是一项十分重要的任务。
氟的化学性质活泼,在化合物中显-1氧化态,它的化学性质可以概括为以下几个方面:
1、氟与金属的反应
2、氟与非金属的反应
3、氟与水的反应
4、卤素间的置换反应
5、氟的制备
氟与金属的反应
氟在低温或高温下都可以和所有的金属直接作用,生成高价氟化物。氟与铜、镍、镁作用时,由于在金属表面生成薄层金属氟化物而阻止了反应的进行,因此氟可以贮存在铜、镍、镁或它们的合金制成的合金中。
nF2+ 2M = 2MFn
(M = 金属)
氟与非金属的反应
氟几乎与所有的非金属(氧、氮除外)都能直接化合,甚至在低温下氟仍可以与硫、磷、硅、碳等猛烈反应产生火焰。
F2 + 2S = S2F2 2F2 + Si = SiF4
2F2 + S = SF4 3F2 + 2P = 2PF3
3F2 + S = SF6 5F2 + 2P = 2PF5
甚至极不活泼的稀有气体氙Xe,也能在523K与氟发生化学反应生成氟化物。
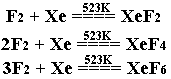
氟与非金属元素的作用通常是剧烈的,这是因为生成的氟化物具有挥发性,它们的生成并不妨碍非金属表面与氟的进一步作用。
氟在低温和黑暗中即可和氢直接化合,放出大量的热并引起爆炸。
F2 + H2 ==== 2HF
氟与水的反应
卤素单质较难溶于水,卤素与水可能发生以下两类反应:
(1)X2 + H2O = 2HX + 1/2 O2↑
(2)X2 + H2O = HX + HXO↑
(X= F、Cl、Br、I)
我们先来看看第一类反应:
(1)X2 + H2O = 2HX + 1/2 O2↑
在这类反应中卤素作为氧化剂,水作为还原剂组成了一个氧化还原反应。该反应是由下面两个半反应组成的:
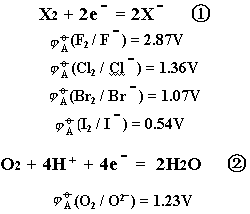
以pH为横坐标,标准电极电势为纵坐标作图,就可得到卤素与水反应的pH电势图:
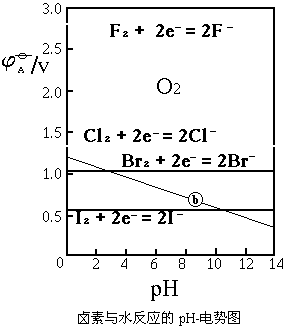
半反应②式相应于图中的b线。其它四条线相应于半反应①式中的F、Cl、Br和I。b线的上方代表O2存在区,b线的下方表示水的稳定区。
从图中可以看出,F2与水反应的趋势最大,Cl2次之,它们在一般酸性溶液中就能发生反应;当水溶液的pH>3时,Br2才能发生反应;水溶液的pH>12时,I2才能发生反应。
我们再来看看第二类反应:
(2)X2 + H2O = HX + HXO↑
这是卤素在水中发生的氧化还原反应,氧化作用和还原作用同时发生在同一分子内的同一种元素上,即该元素的原子一部分被氧化,氧化数升高,同时另一部分原子被还原,氧化数降低,这种自身的氧化还原反应称为歧化反应。
氟由于不能生成正氧化态的化合物,所以它与水不发生歧化反应。
氯与溴对水的反应从热力学角度看可以发生第一类反应,但由于第一类反应的活化能较高而实际上速度很慢,事实上氯与溴对水进行的是第二类反应──歧化反应。歧化反应进行的程度与溶液的pH有很大关系,碱性条件有利于歧化反应的进行。
根据上述分析的情况,让我们看看氟与水反应的实验事实:
氟与水反应的事实
氟与水反应
氟不溶于水,但它与水反应剧烈,分解水放出氧气,这是个很强的、自发的和放热的反应。反应中氟作为氧化剂,水作为还原剂,是第一类氧化还原反应。
2F2 + 2H2O = 4HF + O2↑
氟与水不发生第二类的歧化反应,但在碱性条件下,氟与碱的反应和其它卤素不同:
2F2 + 2NaOH = 2NaF + OF2↑+ H2O
2F2 + 4OH- = 4F- + O2↑+ 2H2O
当碱液较浓时,则OF2被分解放出O2。这实际与第一类反应一样,是个氧化还原反应。
卤素间的置换反应
从卤素的电势图可以看出,卤素单质都是氧化剂,它们的标准电极电势值按F,Cl,Br,I的顺序依次降低,所以卤素单质的氧化能力按此顺序依次降低。而卤离子的还原能力按此顺序依次增强。
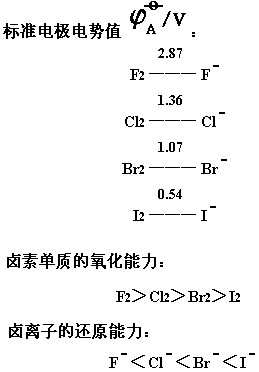
现在我们举例说明上述结论。
氯气能氧化溴离子和碘离子成为单质。由于氯气是个较强的氧化剂,如果氯气过量,则被它置换出的碘将进一步氧化成高价碘的化合物。
Cl2+ 2NaBr = Br2+ 2NaCl
Cl2+ 2NaI = I2+ 2NaCl
I2+ 5Cl2+ 6H2O = 2IO3-+ 10Cl-+ 12H
溴能氧化碘离子成为碘单质。
Br2+ 2NaI = I2+ 2NaBr
有关卤离子的还原能力请看“氟化氢和氢氟酸”。
氟的制备
实验室中,可用含氟化合物的分解反应制取少量的氟:
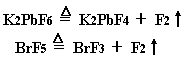
但这种方法不能认为是化学方法制取氟,因为K2PbF6和BrF5的制备过程中要以F2为原料,因此只能认为是氟的储存和释放。
实验室中用化学方法制备单质氟是以HF、KF、SbCl5和KMnO4为原料,首先分别制备出K2MnF6和SbF5,再以K2MnF6和SbF5为原料制备MnF4,MnF4不稳定,可分解放出F2:
由于F-离子是极弱的还原剂,不可能用化学方法把它氧化,因此工业上用最强有力的氧化还原手段──电解氧化法──来制备单质氟:
阳极:2F- = F2↑+ 2e-
阴极:2HF2-+ 2e- = H2↑+ 4F-
用三份氟氢化钾KHF2和两份无水氟化氢HF(含水量低于0.02%)的混合物为电解质,用铜制的容器作电解槽,槽身作阴极,石墨作阳极,在373K左右进行电解。
电解总反应:2KHF2 = 2KF + F2↑+ H2↑
氟化氢和氢氟酸
关于卤化氢和氢卤酸,我们从三个方面来讨论:
1、卤化氢的性质
2、氢卤酸的性质
3、卤化氢和氢卤酸的制备
卤化氢的性质
卤化氢都是具有强烈刺激性臭味儿的无色气体。在空气中会“冒烟”,这是因为它们与空气中的水蒸气结合形成了酸雾。
由表中的数据可以看出:
卤化氢的性质按HCl—HBr—HI的顺序有规律的地变化,例如它们的熔沸点随着分子量的增加而升高。但HF表现例外,它的熔沸点和汽化热反常,特别高,它生成时放出的热量及键能都很大。
反常的原因是HF分子之间存在氢键,而其他卤化氢分子中没有这种缔合作用。因此HF的熔沸点和汽化热特别高。
卤化氢都是极性分子,HF分子极性最大,HI分子极性最小。它们在水中有很大的溶解度。卤化氢的水溶液叫氢卤酸。
氢卤酸的性质
除氢氟酸外,其余的氢卤酸都是强酸,并按照HCl—HBr—HI的顺序,酸性依次增强。
在常压下蒸馏氢卤酸,都可以得到溶液的组成和沸点恒定不变的恒沸溶液。
强酸性和卤离子的还原性是氢卤酸的主要化学性质。卤离子的还原能力按F-<Cl-<Br-<I-的顺序依次增强。
例如:
氢碘酸在常温时即可被空气中的氧气所氧化;而氢溴酸和氧的反应进行得很慢;氢氯酸即盐酸不能被氧气所氧化,但在强氧化剂作用下可以表现出还原性;而氢氟酸没有还原性。
4HI + O2=2I2+ 2H2O
4HBr + O2=2Br2+ 2H2O(慢)
4HCl +O2≠不反应
卤化氢和氢卤酸的制备
在实验室制备卤化氢和氢卤酸的方法有两种:
1、金属卤化物与浓硫酸作用
(1)氟化氢和氢氟酸的制备
反应①用萤石为原料制取氟化氢,氟化氢用水吸收就成为氢氟酸。要把氢氟酸保存在铅、石蜡或塑料瓶中,因为氢氟酸能与SiO2或硅酸盐(玻璃的主要成分)反应生成气态的、易挥发的SiF4,而其它的氢卤酸都没有这个性质。
CaF2+ H2SO4(浓) = CaSO4+ 2HF↑ ①
4HF + SiO2= SiF4↑+ 2H2O
6HF + CaSiO3= SiF4↑+ CaF2+ 3H2O
(2)氯化氢和氢氯酸的制备
反应②是实验室制备氯化氢的方法,氯化氢用水吸收就成为氢氯酸即盐酸。
NaCl + H2SO4(浓) = NaHSO4+ HCl↑ ②
(3)溴化氢和氢溴酸,碘化氢和氢碘酸的制备
用反应③和④的方法不能制备出纯的溴化氢和碘化氢。因为生成的HBr和HI会被浓硫酸进一步氧化。
NaBr + H2SO4(浓) = NaHSO4+ HBr↑ ③
NaI + H2SO4(浓) = NaHSO4+ HI↑ ④
2HBr + H2SO4(浓) = SO2+ Br2+ 2H2O
8HI + H2SO4(浓) = H2S↑+ 4I2+ 4H2O
在实验室中用金属卤化物制取溴化氢和碘化氢,要用没有氧化性和挥发性的磷酸来代替浓硫酸。将溴化氢或碘化氢溶于水就可以得到氢溴酸或氢碘酸。
NaBr + H3PO4= NaH2PO4+ HBr↑
NaI + H3PO4= NaH2PO4+ HI↑
从②③④三个反应进行的程度看,按此顺序一个比一个剧烈。这可以说明Cl-、Br-、I-离子的还原能力按此顺序依次增强。
2、非金属卤化物水解
采用非金属卤化物水解的方法制取HBr和HI。例如反应式⑤是把溴滴加到磷和少许水的混合物上制取HBr,反应式⑥是把水滴加到磷和碘的混合物上制取HI。
3Br2+ 2P + 6H2O = 2H3PO3+ 6HBr↑ ⑤
3I2+ 2P + 6H2O = 2H3PO3+ 6HI↑ ⑥
氟的氧化物
由于氟的电负性(3.98)大于氧(3.44),氟和氧的二元化合物是氧的氟化物而不是氟的氧化物。
二氟化氧OF2是无色气体,是强氧化剂,它与金属、硫、磷、卤素剧烈反应生成氟化物和氧化物。
把单质氟通入2%的NaOH溶液中可制得OF2:
2F2 + 2NaOH = 2NaF + H2O + OF2↑
OF2溶于水可得到中性溶液,溶解在NaOH溶液中得到F-和氧气,它不是酸酐。
 收藏此帖
收藏此帖 收藏此帖
收藏此帖